心臟瓣膜病是全球心血管疾病發(fā)病和死亡的主要原因,且目前沒(méi)有藥物可以阻止瓣膜惡化,因此瓣膜置換手術(shù)依舊是最有效的治療方案。目前臨床中使用的心臟瓣膜假體主要可以分為機(jī)械瓣膜和生物瓣膜兩種。其中,機(jī)械瓣膜雖然使用年限較長(zhǎng)但是患者需要進(jìn)行終身的抗凝血治療,而生物瓣膜由于不可再生和鈣化導(dǎo)致其使用壽命僅為10-15 年。面對(duì)這些挑戰(zhàn),具有再生能力的組織工程心臟瓣膜的開(kāi)發(fā)具有重大意義,但該種新型瓣膜假體的構(gòu)建通常涉及到復(fù)雜的多種功能性藥物分子的負(fù)載等復(fù)雜設(shè)計(jì),這也極大的限制了其臨床轉(zhuǎn)化的潛力。
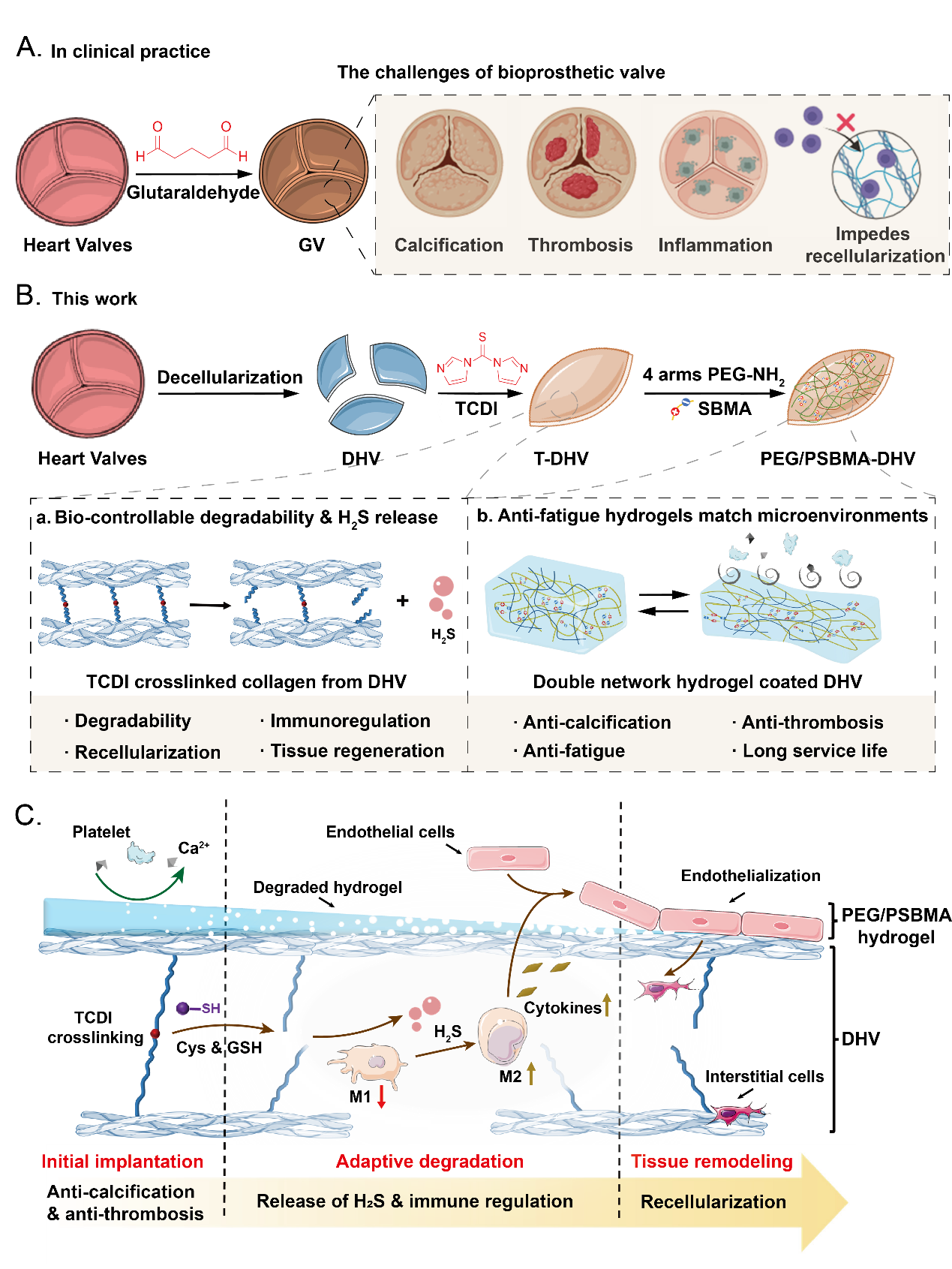
Figure. 1 PEG/PSBMA-DHV的制備及機(jī)制示意圖
傳統(tǒng)的基于共價(jià)鍵的交聯(lián)策略,在提高瓣膜的力學(xué)強(qiáng)度的同時(shí)也會(huì)導(dǎo)致致密的孔隙結(jié)構(gòu)的形成,同時(shí)由于其不可降解性導(dǎo)致在一定程度上妨礙了細(xì)胞的浸潤(rùn),不利于再細(xì)胞化和組織再生。此外,傳統(tǒng)的組織交聯(lián)劑通常為生物惰性,難以指導(dǎo)細(xì)胞行為促進(jìn)再生。理想的組織交聯(lián)劑應(yīng)該在材料植入體內(nèi)后能夠展現(xiàn)出緩慢降解的能力,滿(mǎn)足細(xì)胞浸潤(rùn)的需求。同時(shí),應(yīng)該具備生物活性進(jìn)一步加速再生進(jìn)程。那么,如何通過(guò)高效且簡(jiǎn)單的策略實(shí)現(xiàn)對(duì)組織交聯(lián),同時(shí)滿(mǎn)足上述需求,是目前亟需解決的問(wèn)題。
在本文中,吳鈺周教授及其團(tuán)隊(duì)提出了一種創(chuàng)新且高效的策略,利用1,1'-硫羰基二咪唑(TCDI)的化學(xué)特性,開(kāi)發(fā)了一種新型交互式心臟瓣膜再生材料。這種材料基于TCDI交聯(lián)能夠形成可水解的硫脲和硫代碳酸酯鍵,實(shí)現(xiàn)了在材料降解過(guò)程中能夠逐步釋放硫化(H2S),有效調(diào)節(jié)免疫微環(huán)境,促進(jìn)組織修復(fù)和再生。
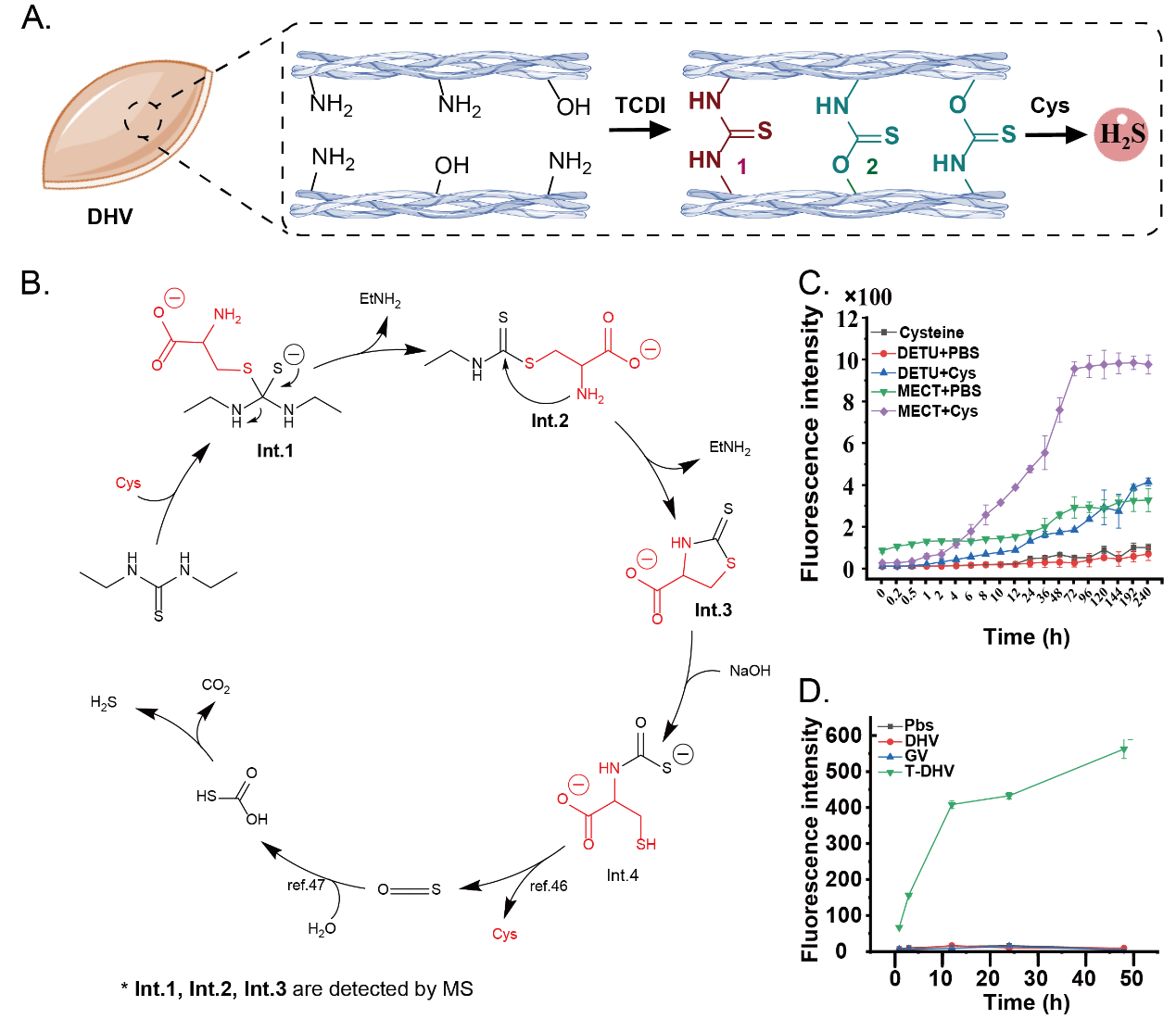
Figure. 2 TCDI交聯(lián)心臟瓣膜的H2S釋放機(jī)制探究
由于心肌的節(jié)律性收縮與松弛,心臟瓣膜會(huì)持續(xù)受到周期性的機(jī)械刺激。這就要求瓣膜材料不僅要在靜態(tài)條件下表現(xiàn)優(yōu)異的抗鈣化和抗蛋白黏附的性能,即使在劇烈的循環(huán)力學(xué)刺激之后,依舊維持良好的性能。因此,研究團(tuán)隊(duì)以TCDI交聯(lián)技術(shù)為基礎(chǔ),在脫細(xì)胞心臟瓣膜(DHVs)表面構(gòu)建了一種PEG/PSBMA雙網(wǎng)絡(luò)水凝膠。該種策略不僅有效提高了心臟瓣膜的力學(xué)強(qiáng)度和穩(wěn)定性,同時(shí)展現(xiàn)出良好的抗疲勞性能,經(jīng)歷500次循環(huán)拉伸測(cè)試后依舊展現(xiàn)出優(yōu)異的抗鈣化和抗蛋白黏附性能。
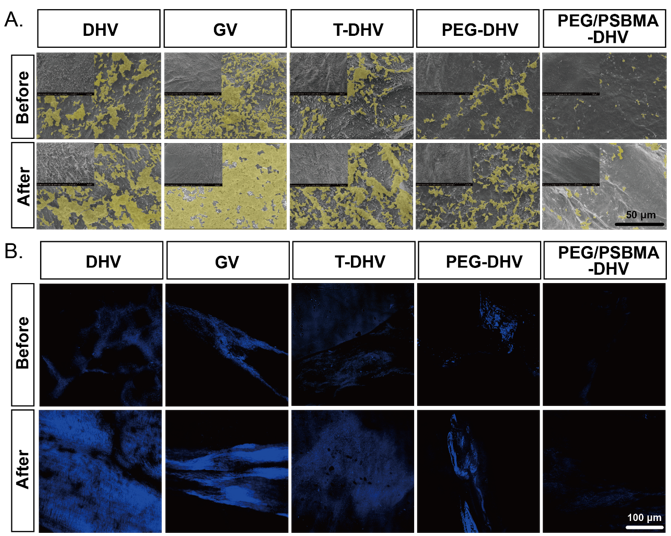
Figure. 3 PEG/PSBMA的抗鈣化和抗蛋白黏附性能評(píng)估
最終,當(dāng)將該材料植入體內(nèi),血液循環(huán)中的半胱氨酸等小分子激活材料的H2S釋放和降解,并驅(qū)動(dòng)巨噬細(xì)胞向M2表型計(jì)劃,促進(jìn)細(xì)胞遷移和組織再生。為了更好模擬心臟瓣膜的體內(nèi)環(huán)境,我們采用腹主動(dòng)脈移植模型評(píng)價(jià)該材料的免疫調(diào)控和再生能力。從實(shí)驗(yàn)結(jié)果能夠看到,植入體內(nèi)28天后,PEG/PSBMA-DHV有效抑制了瓣膜鈣化、 實(shí)現(xiàn)了完整內(nèi)皮細(xì)胞層的重塑并明顯促進(jìn)了一型膠原的重塑。
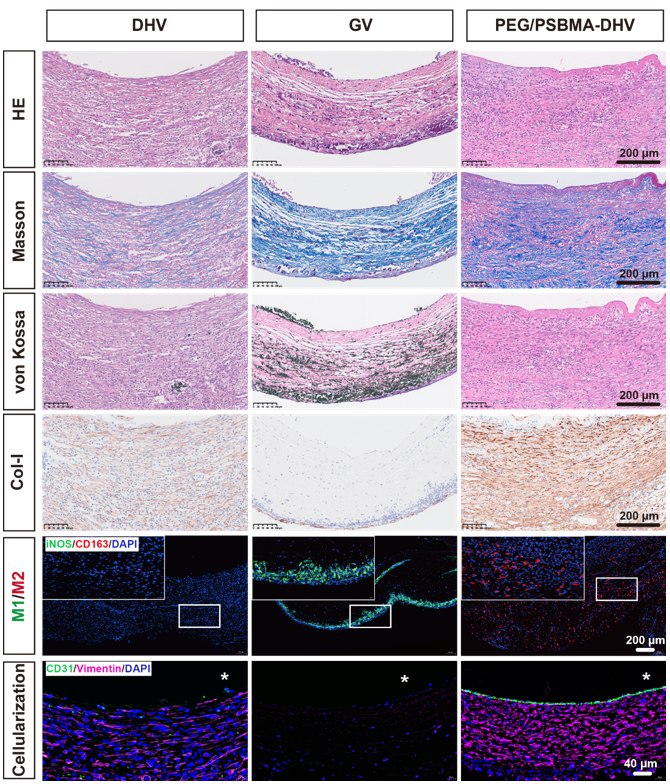
Figure. 4 腹主動(dòng)脈移植四周后的整體性能評(píng)價(jià)
總言而之,該研究利用TCDI作為交聯(lián)劑,解決了非共價(jià)交聯(lián)劑在穩(wěn)定性和力學(xué)強(qiáng)度方面的不足,同時(shí)也克服了不可降解的共價(jià)交聯(lián)劑可能導(dǎo)致的細(xì)胞浸潤(rùn)和組織再生受阻的問(wèn)題。其所具備的H2S釋放能力也賦予PEG/PSBMA-DHV調(diào)節(jié)免疫反應(yīng)的能力,有效地誘導(dǎo)巨噬細(xì)胞向具有抗炎和促進(jìn)組織再生的表型轉(zhuǎn)變。通過(guò)這種創(chuàng)新的方法,PEG/PSBMA-DHV在心臟瓣膜的內(nèi)皮化、細(xì)胞化和組織重塑方面展現(xiàn)出了卓越的潛力,為心臟瓣膜的修復(fù)和再生提供了一種有效的解決方案。
上述研究成果近期于Nature Communications期刊在線發(fā)表,“Facile engineering of interactive double network hydrogels for heart valve regeneration” (DOI: 10.1038/s41467-024-51773-0)。華中科技大學(xué)化學(xué)與化工學(xué)院吳鈺周教授和華中科技大學(xué)同濟(jì)醫(yī)學(xué)院附屬協(xié)和醫(yī)院董念國(guó)教授、史嘉瑋教授為本文通訊作者,2022級(jí)博士研究生李金生和附屬協(xié)和醫(yī)院?jiǎn)添|華為論文第一作者,華中科技大學(xué)為唯一通訊單位。
